耳がかゆくなって、つい綿棒で掻きむしってしまったご経験はありませんか?
“いつもお風呂上がりに綿棒できれいにしているはずなのに、綿棒で触るとなにか濡れたものがついてくる。汚れを気にして耳そうじを続けていると、だんだんかゆくなってきて、そのうち痒み(かゆみ)が我慢できなくなってきた。痒くて痒くてたまらなくなって、ついに綿棒で耳の中をつよく掻きむしってしまったら、そのあとすこし痛みがあって、痒みはすこしおちついた。でも、また耳が痒くなる。そして、また耳かきをする。痒みはどんどんひどくなっている気がする。”
こんなご経験をお持ちの方もおられるのではないでしょうか。
耳が痒くて痒くて我慢できないと、よくないと思いながら、つい綿棒で強めに耳かきしてしまいますね。
中には、やっぱりこれじゃないとダメだ、と言われて、木製や金属製の硬い耳かきを使って、耳かきをされる方もおられます。
耳かきの種類はさておいて、耳が痒くなるのは一体どうしてなのでしょう?
そして、耳かきすると、どうして痒みはおさまるのでしょう? また痒くなるけど、耳かきするとおさまります。
そのうち、耳の中をかいてもかいても痒みがおさまらず、どんどん痒みがひどくなってきたとき、皆さんは耳鼻咽喉科へ行ってみようかな、と思われます。
今回は、耳のかゆみについて書いてみます。
痒みとは、何でしょう?
痒みとはいったい何なのでしょう。
痒みはとても身近にある感覚ですね。誰しも、痒みを感じたことのない方はおられません。
でもよく考えてみてください。痒みについて、あなたはどれだけのことをご存知ですか?
まずは、痒みとは一体どんな感覚で、どのように感じて、どう伝わるのか? それについて知っておく必要があります。
痒みが、どうおさまるかについても。
でも、ここで1つ重要なことがあります。
痒みについて知ることは、じつは半分、痛みについて知ることなのです。痒みについての説明は必ず、痛みについての説明と重なります。
痒みの話をしたいのですが、途中でかならず、痛みの話が出てきます。痛みと鎮痛の受容体、受容体と痒みの関係、などすこしだけ複雑なこともでてきます。
逆に痛みについての正しい理解がなければ、痒みについては、本当の意味で理解が進みません。
そこで、すこし本題からは逸れますが、まずは痛みについて、すこし詳しく説明していきたいと思います。
痛みのコントロール
痛みはつらい感覚です。しかし生物が生きていくために必要な感覚でもあります。ヒトを含むすべての動物が生き残っていくため、痛覚は大昔から人にとって最も身近に存在している感覚です。
この痛みの苦しさから逃れるために、人類はあらゆることを試してきました。その経験の中で、やがて一部の植物の中に、劇的に痛みを消し去ってくれる成分が含まれていることを知り、痛みのコントロールに使い始めます。
これが天然のアルカロイドです。自然界に存在する最も有名な鎮痛薬が、ケシの華から採れるアヘン、そしてアヘンから抽出されるモルヒネです。
痒(かゆ)みは、不思議な感覚です。痒くて痒くてたまらない、不快な気分は、誰しも一度ならず経験したことがあるでしょう。
痒いから掻く。この一見単純な行為の中に、じつは非常に深い科学が隠されています。
痛みと痒み。
この一見すると、全く関係なさそうな2つの感覚は、じつは深いところで繋がっています。
まずは、痛みとそのコントロールについて、すこし理解しましょう。
オピオイド、という物質
オピオイド(Opioid)とは、モルヒネ様物質のことです。
オピオイド(Opioid)は、① ケシ(opium)から採取されたアルカロイド、② ケシから合成された化合物や半化合物、③ 体内に存在する内因性の化合物の総称です。
簡単に言うと、麻薬です。
オピオイドには、鎮痛、陶酔作用があります。そのため医療においては手術や、がんの疼痛管理のような強い痛みのコントロールに不可欠となっています。
一方でオピオイドは、高用量の摂取で昏睡や呼吸抑制を引き起こします。
このようなアルカロイドやその半合成化合物には、モルヒネ、ジアセチルモルヒネ、コデイン、オキシコドンなどがあり、合成オピオイドにはフェンタニル、メサドン、ペチジンなどがあります。
生体内に存在する内因性オピオイドには、エンドルフィン、エンケファリンなどがあります。これらは、人間の体内で自然に作られる脳内麻薬です。
内因性オピオイド
体内に存在する内因性オピオイドは、作用するオピオイド受容体サブタイプの違いによって、
① エンドルフィン類(μ 受容体)
② エンケファリン類(δ 受容体)
③ ダイノルフィン類(κ 受容体)
* μ ミュー δ デルタ κ カッパ
の3つに分類されています。
人間の体が合成する脳内麻薬も、鎮痛のために外から取り入れるモルヒネも、これらの3つの鎮痛の受容体(μ、δ、κ)に結合して、強力な鎮痛作用を発現します。
この鎮痛の受容体を、オピオイド受容体といいます。
* 内因性 生体内で合成されること、の意味
内因性オピオイドとは、生体内で合成される麻薬様の鎮痛物質のこと 前述のエンドルフィン等
オピオイド受容体
オピオイド受容体は痛覚の侵害受容器の神経線維であるC線維やAδ線維のシナプス前の末端部に存在します。
このオピオイド受容体に、内因性オピオイドが結合すると、以下のことが起こります。
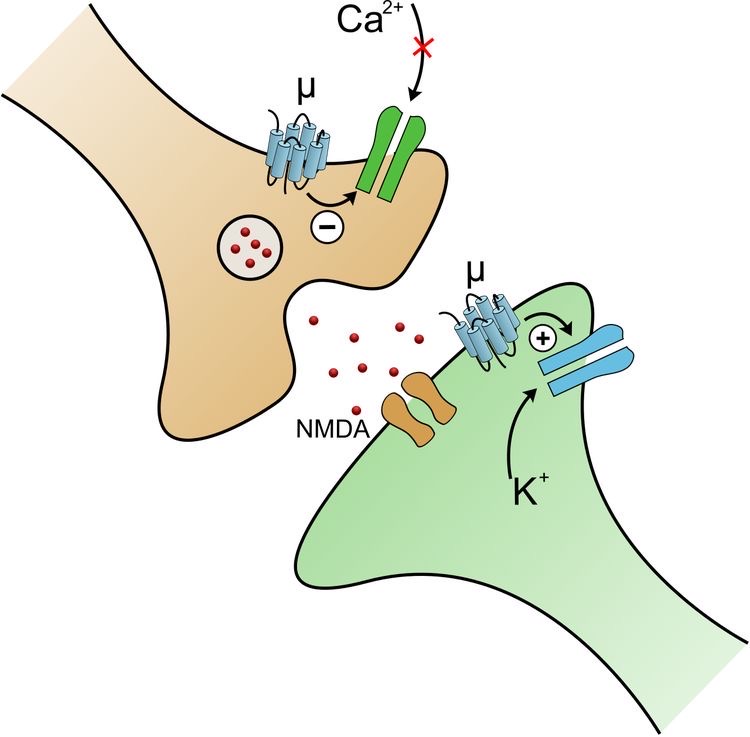
図1 μ受容体はシナプス前部と後部に存在する
https://ja.m.wikipedia.org/wiki/%E3%82%AA%E3%83%94%E3%82%AA%E3%82%A4%E3%83%89%E5%8F%97%E5%AE%B9%E4%BD%93
① μ受容体はシナプス前部のカルシウムチャネルをブロックして、グルタミン酸やサブスタンスPなどの疼痛伝達物質の放出を抑制します。その結果、グルタミン酸受容体であるNMDA受容体の興奮を抑制します。
② μ受容体はシナプス後部のカリウムチャネルを開口します。シナプス後部神経細胞から細胞外へカリウムが流出して、シナプス後部の興奮が抑制されます。
μ受容体
μ受容体は、このような構造をしています。
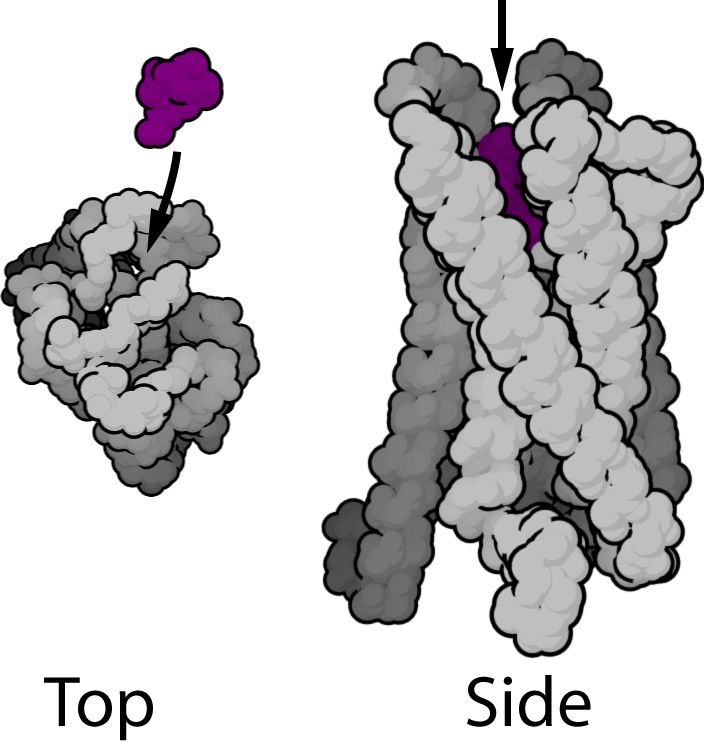
図2 μ受容体のイラスト (紫色🟪 オピオイド)
https://ja.m.wikipedia.org/wiki/%E3%82%AA%E3%83%94%E3%82%AA%E3%82%A4%E3%83%89%E5%8F%97%E5%AE%B9%E4%BD%93
μ受容体は、Gタンパク質共役受容体(GPCR)です。細胞膜を7回貫通型の細胞膜上の受容体です。
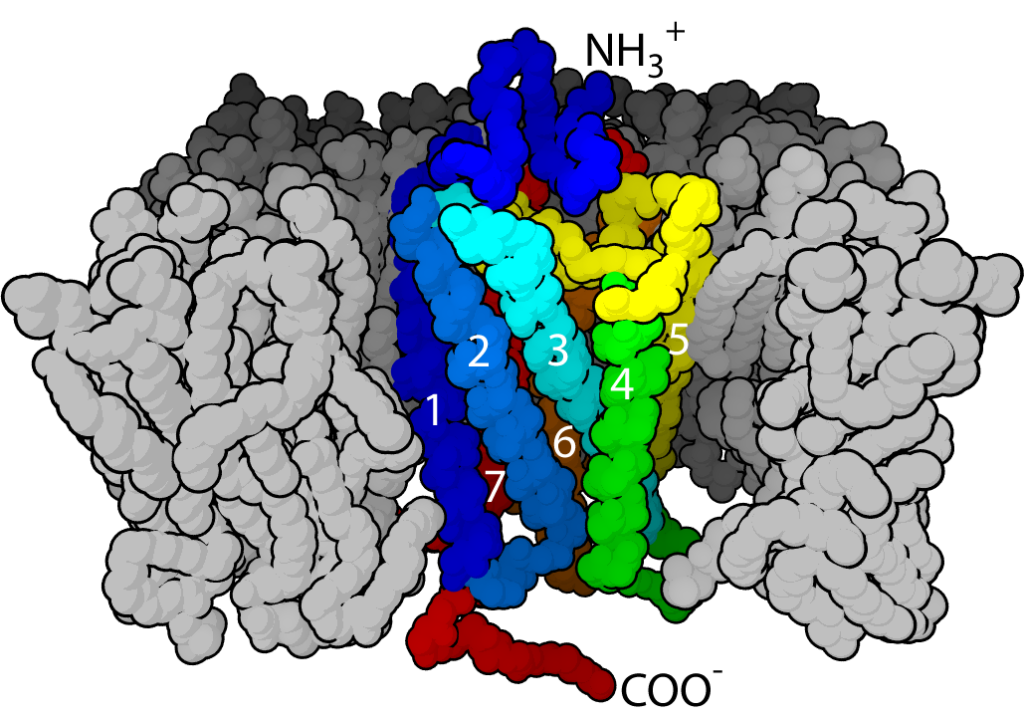
図3 GPCRの一般的構造 (bovine rhodopsin)
細胞膜を7回貫通する
https://en.m.wikipedia.org/wiki/G_protein-coupled_receptor
GPCRは、オピオイド系鎮痛薬、抗ヒスタミン薬、多くの抗精神病薬など、全薬剤の約3分の1の受容体となります。生体内で薬剤が薬理作用を発現するための非常に重要な受容体です。
このμ受容体には、体内に存在する内因性オピオイド、エンドルフィン類がくっつきます。
エンドルフィン(endorphin)は、おもに脳内で働くモルヒネ類似のペプチドで、神経伝達物質です。体内で合成されるオピオイドであり、モルヒネと同じように鎮痛薬として働きます。生体内での鎮痛系だけでなく、脳内の報酬系に多く分布します。多幸感をもたらすことでも有名です。
エンドルフィンには、α、β、γの3種類があり、このうちβエンドルフィンが脳内鎮痛に働くとされています。
βエンドルフィンは、脳下垂体でペプチド前駆体の、POMC(プロオピオメラノコルチン)から作られます。POMCからは、ACTHも産生されます。
βエンドルフィンは、視床下部や脳下垂体の神経細胞に存在しています。脳室系に放出されて、脳脊髄液を介して脊髄や全身に拡散するため、末梢神経にも作用します。
βエンドルフィンは、μ受容体と内因性オピオイド中最も高い選択性で結合します。タンパク分解酵素に抵抗性をもち、効果が長く持続しやすいようになっています。
βエンドルフィンの効果は、優れた鎮痛作用です。モルヒネもこのμ受容体に結合します。
μ受容体は、Gタンパク質共役受容体(GPCR)であり、受容体にモルヒネやβエンドルフィンが結合すると、GPCRの2つのシグナル伝達経路、① cAMP 系、② phosphatidylinositol 系を介して細胞内シグナリングが進行します。
μ受容体などのGPCRの活性化は、以下のように進行します。
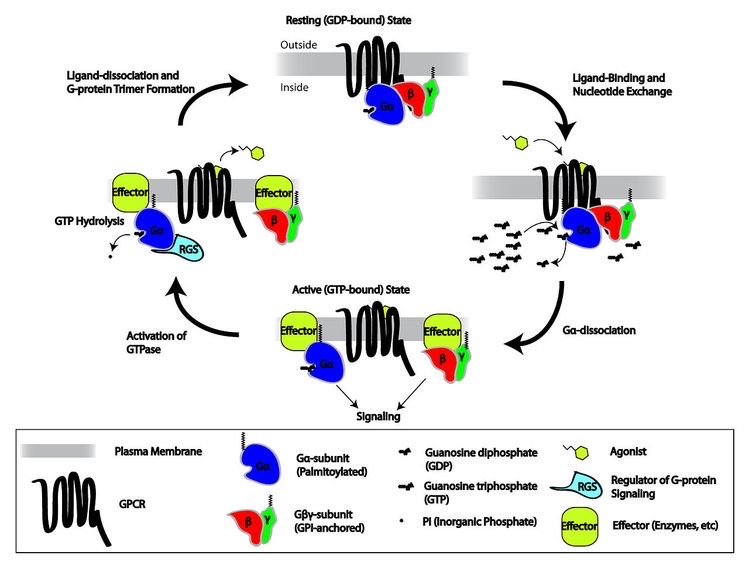
図4 GPCRの反応モデル
GPCR(図4 黒線)は細胞膜内にαβγの3つのGタンパクをもっています。(図4 青🔵赤🔴緑🟢)
βエンドルフィンなどのリガンドがGPCRに結合すると、Gタンパクは、αサブユニット単独とβγサブユニットに分離して、それぞれ他の酵素、チャネルなどに作用します。
細胞内のcAMP系とphosphatidylinositol 系の2つの伝達経路が活性化されて、最終的にμ受容体をもつ神経細胞の細胞膜上の電位依存性カルシウムチャネルとカリウムチャネルが阻害されます。
神経細胞内へのカルシウムの流入ブロックと細胞外へのカリウム流出によって、シナプスでのグルタミン酸、サブスタンスPの放出抑制とシナプス後神経細胞の過分極が起こり、痛みの伝導がブロックされます。(図1)
βエンドルフィンは、ドーパミンの放出を阻害するGABAの放出を阻害します。その結果、ドーパミンの放出が増えて、ドーパミンの作用によって鎮痛効果が増強されます。
βエンドルフィンの鎮痛効果はモルヒネの18-33倍であると言われています。
κ受容体とダイノルフィン
κ(カッパ)受容体は、エンドルフィンと同じく内因性オピオイドである、ダイノルフィンの受容体です。
ダイノルフィン(Dynorphin)は、視床下部、線条体、海馬、脊髄などの多くの神経細胞で産生されるペプチドです。
ダイノルフィンは、モルヒネの6-10倍の鎮痛作用をもつと推定され、モルヒネと併用することで効果を増強することがわかっています。
その反面、ダイノルフィンはモルヒネによる鎮痛効果を減弱させる実験結果や、痛みを増強させる作用があることを示す実験結果が複数報告されています。
この矛盾点にはいくつかの仮説が提唱されていますが、ダイノルフィンはオピオイド受容体であるκ受容体に結合すると同時にブラジキニン受容体にも結合する可能性が指摘されています。
モルヒネの副作用
ここで、昔から強力な鎮痛薬として医療分野でも使用されてきたモルヒネについて、考えてみましょう。
モルヒネは、μ、δ、κの3受容体ともに結合可能ですが、μ受容体に結合して強力な鎮痛作用をもちます。
モルヒネの副作用は、薬物依存性、耐性、悪心嘔吐、血圧低下、呼吸抑制などが知られていますが、比較的よくみられる副作用に、”便秘” と“痒み”があります。
モルヒネはμ受容体に結合して強力な鎮痛効果を発揮しますので、この事実から、”μ受容体の活性化が痒みを誘発する可能性” が考えられるようになりました。
痛みと痒み
痛みの受容体、とくに内因性オピオイド受容体について書いてきました。ところが、この内因性オピオイド受容体は、現在では、痛みだけでなく、生体における “痒み” にも深く関係していることが、わかっています。
痒みは、“掻爬(そうは)行動をともなう不快な感覚” と定義されています。しかし、なぜ痒くなるのか、長い間わかっていませんでした。
痛みと鎮痛については先に研究が進んで、内因性オピオイド受容体である、μ受容体、κ受容体に作用するβエンドルフィンやダイノルフィンなどの働きが解明されてきました。
近年、この鎮痛の受容体と痒みの受容体が同じであることがわかり、痒みは、この内因性オピオイド受容体と深く関係していることが研究されつつあります。
* 痛みの感覚の伝達経路と痒みの感覚の伝達経路は、別であることがわかっています。
したがって、オピオイド受容体についての議論は、痛みと痒みの双方の感覚についての議論になっていくのです。
これから、痒みについての説明に移っていきたいと思います。
血中βエンドルフィン濃度
以前から、腎透析中の患者さんは痒みを訴えることが多いことが知られていましたが、その原因は謎でした。
この事実に関して、近年、腎透析中の患者さんで、痒みの強い人ほど、血中のβエンドルフィン濃度が高いことが報告されました。
さらに、血中のβエンドルフィンとダイノルフィンの比率を調べた研究では、痒みのつよい患者さんほど、この比率が高いことが報告されています。
ここで、βエンドルフィンは、μ受容体に結合する内因性オピオイド、ダイノルフィンは、κ受容体に結合する内因性オピオイドでしたね。
* 内因性オピオイド 生体内で合成されるモルヒネ様の鎮痛物質
この事実から現在、
μ受容体作動薬のβエンドルフィンが”痒みを知らせて“、κ受容体作動薬のダイノルフィンが”痒みを抑制している“、
痒みのコントロール機構が考えられています。
痒みとは何か?
痒みとは、”掻きたいという欲求をともなう不快な感覚”とされていました。現代では、“掻爬行動をともなう不快な感覚” と定義されています。掻爬とは”引っ掻くこと”です。
単純な疑問ですが、どうして掻きたくなるのでしょうか?
痒いから掻くことは、“皮膚を傷つけ、皮膚のバリアーを壊して、アレルゲンの侵入を許し、細菌感染の危機を作り、組織の損傷から炎症反応を起こして、免疫応答を促します”。
良くないことばかりです。
人間の体は多くの場合、何か欲求が起こり、それを満たすことで、生体にとって、またその生存に有利にはたらくようにできています。
お腹が空いたらごはんを食べる、喉が渇いたら水を飲む、眠くなったら眠る、などがそれにあたります。どれも体に必要だから、ですね。
生体にとって掻くことが何か良いことでないと、そうはしないはずです。
この問題に答えを出したのが、ピッツバーグ大学(米国ペンシルベニア州)の神経科学者 Sarah Ross 博士らによる、脊髄の後角細胞におけるB5-I ニューロンの発見です。
脊髄の後角には、末梢の感覚神経から入力される細胞群があります。Sarah Ross 博士らは、この細胞群の中に発見されたB5-I ニューロンが、痒みのコントロール(抑制)を行っているという仮説を立てました。
その後いくつかの研究を経て、このB5-I ニューロンがダイノルフィンを分泌することで痒みの伝達を抑制していることが、筑波大学国際統合睡眠医科学研究機構における長瀬 博 教授らの研究によって明らかになったのです。
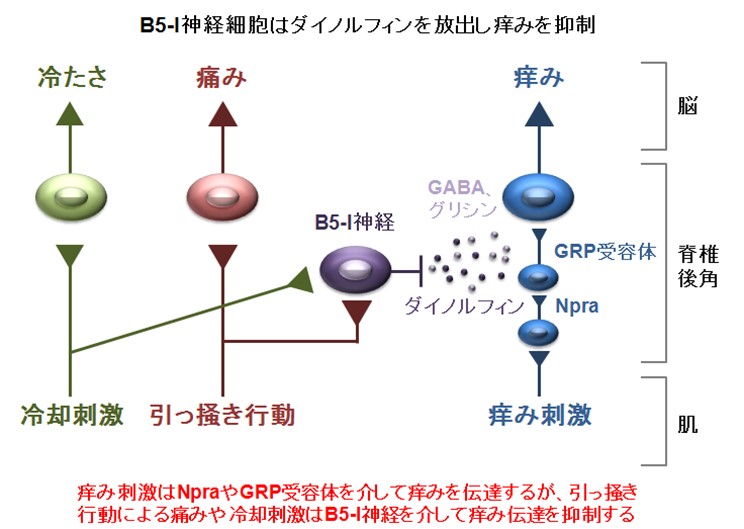
図5 痒み刺激の伝達とB5-I 神経の働き
https://www.tsukuba.ac.jp/journal/medicine-health/20140513140938.html
(夜も眠れないほど辛い痒みが起きるしくみを解明 TSUKUBA JOURNAL 2014.05.13 より引用)
痒みは、Npra、GRP 受容体を経由して伝えられていきます。 (図5 右)
B5-I 神経からダイノルフィン、GABA、グリシンが放出されて、痒みの伝達がブロックされます。 (図5 中央)
では、どのようにしてB5-I 神経が働くのでしょうか? (図5 左)
この優れた理論を理解する前に、まず理解しておくべきことがあります。
それは、痒み刺激の伝わり方、です。
痒みの起こり方
末梢の痒み刺激は、どのようにして起こり、中枢へ伝えられているのでしょうか。
末梢の皮膚などで、痒みをおこす物質を起痒(きよう)物質といいます。
皮膚などの知覚神経終末で、痒みを受容する痒み受容体を掻痒(そうよう)受容器といいます。
起痒物質
代表的な起痒物質と掻痒受容体を示します。
(かゆみの種類、分類 片山一朗 560-563 Jornal of Otolaryngology, Head and Neck Surgery Vol.32 No5 2016 より引用 )
ヒスタミン → ヒスタミン受容体H1, H4
トリプターゼ、トリプシン、SLIGRL → PAR2, 4
クロロキン → Mas related G protein receptor (Mrgpr) A3
Bovine adrenal medullary peptide (BAM)、SLIGRL → Mrgpr C11
β-alanine → Mrgpr D
セロトニン → 5-HT 1, 4, 7
エンドセリン → Endothelin-1
IL-31 → IL-31 R (receptor)
TSLP →CRLF2(cytokine receptor likefactor), CD127
Nppb(Natriuretic polypeptide b)→ Nppb R (脊髄)
GRP(Gastrin releasing peptide)→ GRPR
(脊髄)
イミキモド → TLR7
サブスタンスP → NK-1R
PAF(Platelet activating factor)→ PAFR
ロイコトリエンB4 → LB4R
冷感(<15℃)、酸化ストレス→ TRPA1
熱感(>42℃)、カプサイシン、12-HPETE → TRPV1
非常に多くの痒みを起こす物質とその受容体があります。
掻痒受容器から脊髄後角へ
皮膚において、各種の起痒物質(痒み物質)が、皮下の知覚神経終末にある掻痒受容器に結合して、知覚神経終末に電気的興奮が起こります。
末梢の知覚神経は脊髄後角に入力されますが、この経路には、ヒスタミンを介するヒスタミン依存性経路と、ヒスタミンを介さないヒスタミン非依存性経路の2つがあります。この2つの経路は独立しています。
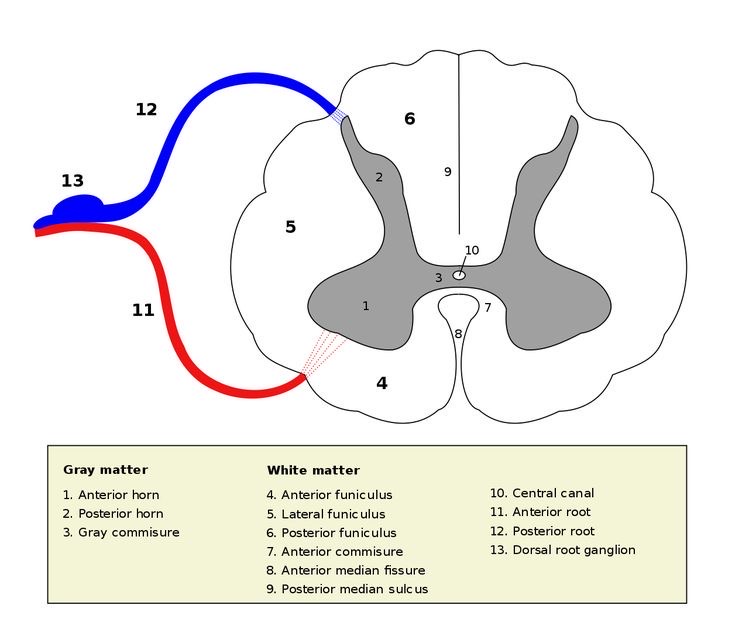
図6 脊髄後角(2)と脊髄後根(12)🟦
皮膚の知覚神経は13→12→2の順で後角に入る
https://ja.m.wikipedia.org/wiki/%E8%84%8A%E9%AB%84
末梢からの痒み刺激は、主として太さ0.5μm の無髄神経C線維を通って脊髄後角(2)に入力されます。(図6 )
神経伝達物質とニューロン
一般に神経と神経が情報伝達をするときは、神経の間隙であるシナプス間に、神経伝達物質と呼ばれるペプチドがシナプス前神経から放出されます。放出されたペプチドは、シナプス後神経の受容体に結合して情報が伝達されていきます。
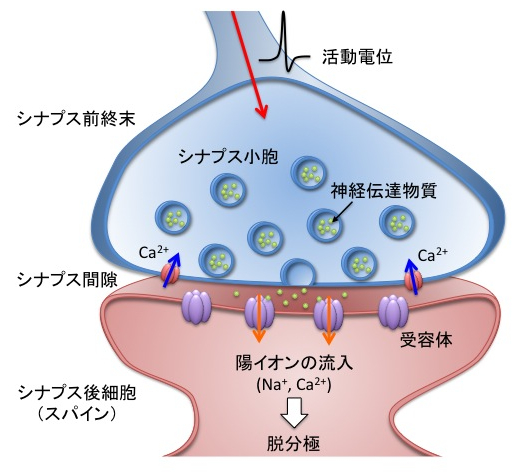
シナプス間隙に放出された神経伝達物質が受容体に結合すると、神経が脱分極して、活動電位が発生します。このようにして電気信号が伝わっていきます。
図1も同じシナプスの図です。比較してください。
脊髄後角の神経細胞で、痒みの伝達に関与する神経伝達物質は、サブスタンスP、ガストリン放出ペプチド(gastrin releasing peptide: GRP)、B型ナトリウム利尿ペプチド(Nppb, BNP)、グルタミン酸などが知られています。
脊髄後角の神経細胞では、痒み刺激はいくつかニューロンを変換して伝達されますが、現在、少なくとも2つのニューロンを経由して伝達されることがわかっています。
Npra が発現しているニューロンとGRPR が発現しているニューロンです。
Npra と GRPR
痒み刺激が伝達されるときにかならず経由するニューロンは、Npra (Natriuretic peptide receptor A)と GRPR (Gastrin-releasing peptide receptor) の2つの受容体を発現していることが、現在わかっています。
Npra
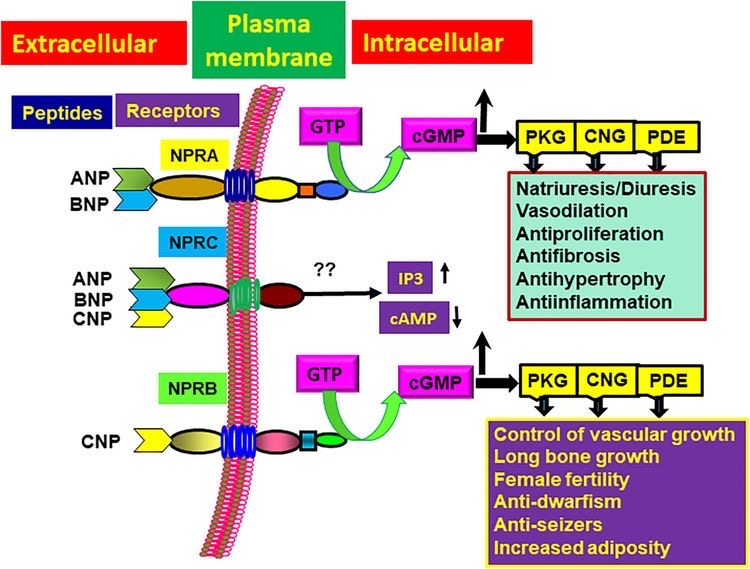
図7 NPRA, NPRB, NPRC の構造モデル
Npra(Natriuretic peptide receptor A)にANP(Atrial natriuretic peptide)、
BNP(Brain natriuretic peptide, Natriuretic polypeptide b, Nppb)
=B型ナトリウム利尿ペプチドが結合する。
https://www.frontiersin.org/articles/10.3389/fphys.2021.693099/full
Npra(Natriuretic peptide receptor A)には、ANP(心房性ナトリウム利尿ペプチド)、BNP(B型ナトリウム利尿ペプチド)の2つが結合します。BNPはNppbのことです。
痒みに関する応答は、Nppbの結合です。
GRPR
GRP受容体(Gastrin releasing peptide receptor, GRPR)
GRP(gastrin releasing peptide)は、元々は胃のG細胞に働いてガストリンを分泌させるペプチドです。このペプチドが近年、脊髄後角において、痒みの伝達に働いていることがわかっています。GRPの受容体がGRPRです。
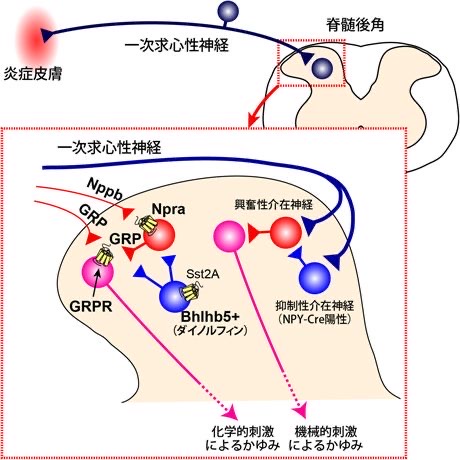
図8 NPRA とGRPR
https://seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2016.880654/data/index.html
痒みの伝わり方と、その抑制
現在、九州大学大学院薬学研究院ライフイノベーション分野の 津田 誠 教授の研究室から、痒みの伝達について図8の理論が提唱されています。
① 痒み刺激によって電気的興奮を起こした知覚神経は脊髄後角に入り、脊髄後角の神経終末からGRP、Nppb などの神経伝達物質が放出されます
② NppbはNppb受容体Npraに作用して、GRPを放出します。放出されたGRPはGRP受容体(GRPR)に作用します。GRP受容体をもつニューロンから痒みが伝達されます。
③ Bhlhb5陽性神経(* B5-I 神経)は、ソマトスタチン受容体Sst2A やダイノルフィンを発現し,かゆみの神経を抑制するようにコントロールします。
* Bhlhb5 Basic helix–loop–helix b5
転写因子。Basic helix–loop–helix とは、2つの α-helix 構造が1本のループでつながった特殊な構造をもつアミノ酸配列。
Bhlhb5 を発現するニューロンをB5-I 神経とも呼んでいる。
* ソマトスタチン受容体Sst2A
ソマトスタチンはガストリンと拮抗する抑制ホルモンです。胃のδ細胞から分泌されて消化管や全身で働きます。
④ 軽い機械刺激による痒みにはNPY-Cre陽性の抑制性神経を含む回路が関与しています。
* NPY-Cre陽性 neuropeptide Y (ニューロペプチドY ) Cre 発現ニューロン
すこし難解ですが、できるだけ簡単にまとめると、以下のようになります。
“痒み刺激は、皮膚から脊髄後角へ伝えられ、Nppb が Npra に結合して、GRP を放出します。GRP がGRPR に結合して、活動電位が脊髄から中枢へ伝達されます”
“Bhlhb5 発現神経(B5-I)が、ダイノルフィンを放出することで、Npra、GRPR の受容体興奮を抑制して、痒みの伝達がブロック(抑制)されます。”
* B5-I ニューロンからは、ダイノルフィン以外にも、グリシン、GABAなどの神経伝達物質が放出されることがわかっています。これらはダイノルフィンと同様に、Npra、GRPR の受容体興奮を抑制して、痒みの伝達をブロックします。
痒みの悪循環
アトピー性皮膚炎などでは、”痒いから、掻いて、また痒くなって、…” という痒みの悪循環が起こります。
これは何故起こるのか、今まで全くわかっていませんでした。
この理由を解明したのが先の、津田誠教授の研究室です。
難解ですのですこし簡単に言うと、以下のようになります。
炎症皮膚での刺激が、温度感受性TRPV1 受容体を興奮させて、脊髄後角で、神経細胞の特殊なアストロサイトを活性化させます。(STAT3+) このアストロサイトから分泌されたリポカリン2 という物質が、GRP の作用を亢進して痒みを強め、さらなる痒みが引っ掻き行動を誘発して皮膚炎が悪化します。
アトピー性皮膚炎の痒みは、通常の痒みとは違って、掻けば掻くほど、痒みが酷くなる、難治性の痒みであることが理解できます。
つまり、アトピー性皮膚炎は掻いても痒みがおさまらないことが、普通の痒みとは根本的に違う点であり、このことが治療に抵抗性を示す1つの原因になっていると考えられています。
これが現在解明された、アトピー性皮膚炎の病態とされています。
詳細な研究報告は、以下よりお読みください。https://seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2016.880654/data/index.html
痒みの起こり方、痒みの伝わり方は、かなり理解できました。でもじつは、肝心なことがまだわかっていません。
痒いとどうして掻くのか?
この当たり前のことが、じつは長い間解明されていませんでした。
ここで、図5をもう一度見てみましょう。

図5(再) B5-I 神経による痒みの抑制
https://www.tsukuba.ac.jp/journal/medicine-health/20140513140938.html
① 痒みは、末梢の皮膚で起痒(よう)物質が掻痒受容体を興奮させて起こること
* 起痒物質 痒みを起こす物質 (例) ヒスタミン、クロロキン 、サブスタンスPなど
② 掻痒受容体からの活動電位が知覚神経終末の無髄神経C線維によって脊髄後角に伝えられること
③ 痒みが脊髄後角にある Npra、GRP受容体を経由して伝えられること
④ 脊髄後角にあるB5-I 神経がダイノルフィン、グリシン、GABAを放出して痒みを抑制していること
が理解できました。
最後の疑問、どうして痒いと掻くのか? についての議論です。
温度感受性TRP 受容体
痛み刺激が伝わるとき、温度感受性TRP 受容体が興奮します。このTRP 受容体は、43℃以上の熱、17℃以下の冷刺激、痛み、などで興奮して活動電位を発生します。
43℃以上の熱やカプサイシン、酸、機械的刺激はTRPV1 受容体を、マスタードオイルや17℃以下の冷刺激はTRPA1 受容体を、メントールなどの清涼刺激はTRPM8 受容体を、それぞれ活性化させます。
これらの受容体からの活動電位は、脊髄後角に入力されます。
ここからが、非常に興味深いことです。
文章を2回読んでください。
痛みと痒み
じつは、TRP 受容体から伝えられた”痛みの情報”は、B5-I ニューロンを介して、”痒みの受容体”のNpra 、GRPR にも同時に入力されているのです。(!)
「カプサイシン、マスタードオイル、メントールの痒い部分への局所投与は痒みを抑制する」ことがわかっています。
詳細な研究によって、現在、次のことが報告されています。(①-③)
① カプサイシンによってTRPV1 受容体が活性化されると、TRPV1 受容体をもつ感覚神経からの入力が、B5-I ニューロンの80%を8倍興奮させます。
② マスタードオイルよってTRPA1 受容体が活性化されると、TRPA1 受容体をもつ感覚神経からの入力が、B5-I ニューロンの86%を3.3倍興奮させます。
③ メントールよってTRPM8 受容体が活性化されると、TRPM8 受容体をもつ感覚神経からの入力が、B5-I ニューロンの90%を2.5倍興奮させます。
④ カプサイシン、マスタードオイル、メントールなどで活性化された各種TRP 受容体は、
B5-I ニューロンの80-90%を3-8倍強く興奮させます。(①-③)
⑤ 興奮したB5-I ニューロンからは、ダイノルフィン、グリシン、GABAが放出されます。
⑥ 放出されたダイノルフィン、グリシン、GABAは、Npra、GRP受容体に作用して、痒みを抑制します。
* 瞬間的な痒みはGABAとグリシンが抑制し、持続的な痒みはダイノルフィンが抑制することがわかっています。
この事実を単純に言い換えると、
つよい熱刺激、痛み、冷刺激、メントールなどは痒みを抑制する、ということです。
もうお気づきだと思います。
これは、私たちが皮膚が痒いときに、昔から本能的にしてきたことです。
冷たい水で冷やす、
メントール成分が入った薬を塗る、
そして、“掻きむしる” こと。
皮膚を掻きむしることで、傷つけて痛みを起こします。その痛みがTRP受容体からB5-I ニューロンへ伝えられて、ダイノルフィンが痒みのNpra、GRP受容体を抑制します。
痛みが痒みを抑えるのです。
だから、わざと痛みを起こすために、掻くのです。
これが、筑波大学国際統合睡眠医科学研究機構における長瀬 博 教授らによって明らかにされた、現在最も信頼性の高い研究報告です。
今までに理解したこと
①鎮痛のオピオイド受容体(μ、κ)のうち、μ受容体が興奮すると痒みが誘発され、κ受容体が興奮すると痒みが抑制される
② 痒みは、皮膚の起痒物質が掻痒受容体を興奮させて、知覚神経の活動電位が脊髄後角へ入力され、脊髄後角にあるNpra、GRP受容体によって痒みが伝達される
③ B5-I ニューロンからダイノルフィンが放出されると痒みが抑制される
④ 冷刺激、メントール、掻いた痛みがTRP温度受容体を活性化させ、B5-I ニューロンを興奮させて、ダイノルフィン、グリシン、GABAが放出される
この4つをよく理解してください。そして、もう一度、この図を見てください。
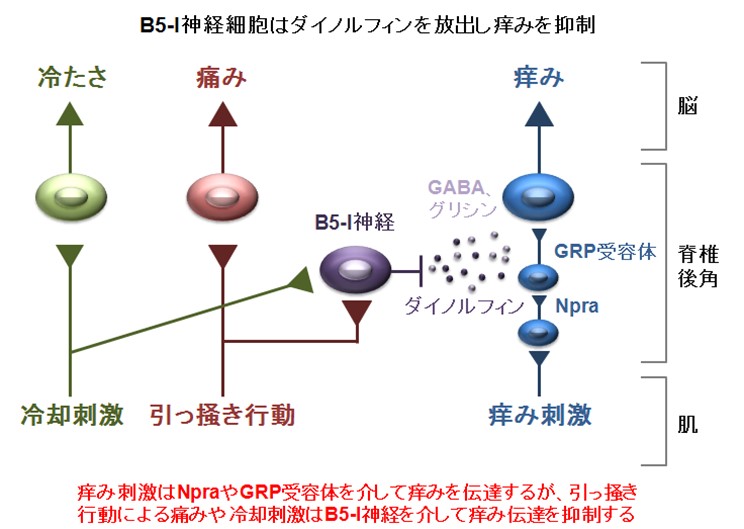
図5(再) 痒み刺激の伝達とB5-I 神経の働き
https://www.tsukuba.ac.jp/journal/medicine-health/20140513140938.html
痒みのメカニズムがよく理解できると思います。
透析患者さんの激しい痒み
腎透析中の患者さん、肝疾患の患者さん、とくに原発性胆汁性肝硬変 (Primary Biliary Cirrhosis)の患者さんでは、夜も眠れないほどの激しい痒みに悩まされます。
さらに、これらの患者さんの激しい痒みは、ふつうの皮膚炎などの痒みに使う抗ヒスタミン薬が全く効果がありません。
これらの激しい痒みを訴える患者さんたちを詳しく調べると、先に書いたように、血液中のβエンドルフィン量が増えて、血液中のダイノルフィン量が減っていることが報告されていました。
β‐エンドルフィンは、μ‐受容体に結合すると痒みを起こします。そして、ダイノルフィンは、κ‐受容体に結合すると、痒みを止めることがわかっています。
痒みのメカニズムで書いた、ダイノルフィンが痒みを抑制することは、これにきれいに合致します。血液中のダイノルフィンが少なくなっているために、κ‐受容体の多くに結合できずに、痒みを抑えられなくなるのです。
したがって、これらの激しい痒みを訴える患者さんの痒みを止めるには、血液中のダイノルフィン量を増やしてあげるか、または、κ‐受容体と結合する物質を増やしてあげれば良いのです。
アトピー性皮膚炎 vs. 皮膚掻痒症
痒みは、臨床的に大きく2つに分類されます。
アトピー性皮膚炎などの皮膚症状をともなう痒みと、皮膚掻痒症と呼ばれる、皮膚症状をともなわない痒みです。
* 皮膚掻痒症というと誤解をまねきそうですが、これは皮膚に痒みがあるという意味であって、皮膚症状をともなわないため、皮膚炎などは全くありません。そのため、”皮膚症状をともなわない” 痒みに分類されています。
簡単に言うと、皮膚症状をともなう痒みは、末梢性(皮膚)の痒みで、皮膚症状をともなわない痒みは、中枢性の痒みです。
皮膚症状をともなう痒みは当然ながら、主に皮膚疾患です。
皮膚から痒み刺激が脊髄後角へ入力される伝達経路には、ヒスタミン依存性経路とヒスタミン非依存性経路がありますが、多くは抗ヒスタミン薬がある程度の効果を示します。
それに対して、皮膚疾患をともなわない痒みは、”皮膚掻痒症“と呼ばれていて、先に書いた、腎透析中や肝疾患の患者さんの激しい痒みはこれにあたります。
皮膚掻痒症の患者さんの痒みの多くは、抗ヒスタミン薬が効きません。そのため夜間も昼間も激しい痒みに悩まされて、精神的にも肉体的にも苛まれます。
夜も眠れないほど激しい痒みがあるのに、残念なことに、痒みを止める有効な薬がなかったのです。
少なくとも10年ほど前までは。
ナルフラフィン
先の筑波大学の長瀬 博 教授らのグループは、世界初の選択的κ受容体作動薬であるナルフラフィンを開発して、2009年、難治性掻痒症治療薬”レミッチカプセル“として発売しました。
ナルフラフィン(塩酸塩)は、今まで抗ヒスタミン薬が全く効かず、痒みを止める薬が存在しなかった腎透析中や慢性肝炎などによる難治性掻痒症の激しい痒みに対して非常に有効であり、多くの患者さんの不快な激しい痒みを和らげるのに役立っています。
写真1 レミッチカプセル(2.5 μg) 東レ/鳥居薬品
この研究は、痛みを止める受容体であるκ受容体が、じつは痒みを止める受容体であったことから発展しました。
このκ受容体作動薬(レミッチカプセル)は、同じ鎮痛に関与するオピオイド受容体のうちでも、μ受容体のようにモルヒネ様の薬物依存性がない点で、さらに薬物嫌悪性も回避された点で非常に優れており、初めて臨床応用が可能になりました。
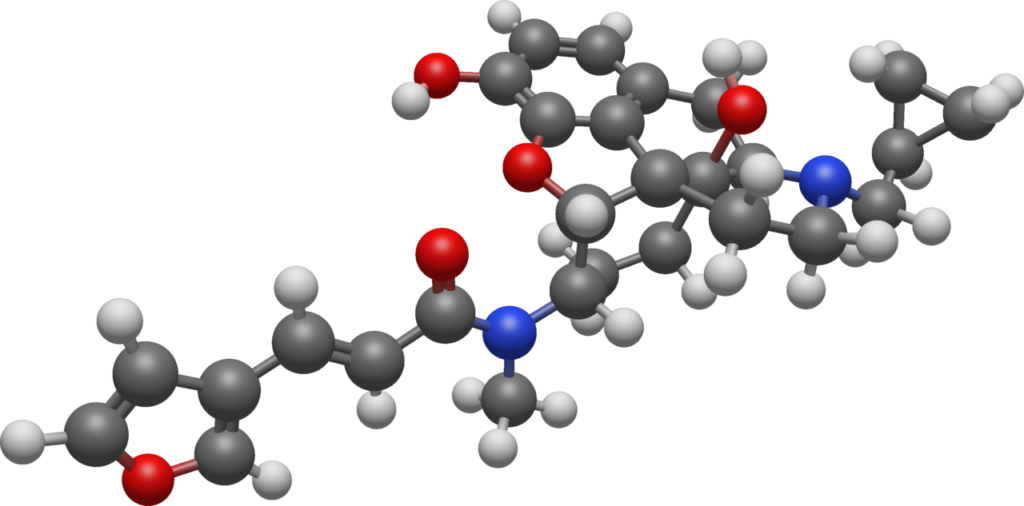
図9 ナルフラフィン分子構造
https://en.m.wikipedia.org/wiki/Nalfurafine
ナルフラフィン(Nalfurafine)は、アルコール依存や麻薬依存の患者さんに作用される麻薬拮抗薬である、ナルトレキソン(Naltrexone)から開発が始まりました。
当初、ナルフラフィンは術後疼痛治療薬として開発が始められ、それが腎透析中の重篤な痒みにも有効であったことから、その強力な止痒作用に注目され、止痒薬として新薬の開発へと劇的な発展を遂げた経緯があります。
この事実からも、痛みと痒みは、非常に”近い” 関係にあることがうかがわれます。
ちなみに、レミッチカプセルの “レミッチ” は、”remove itch“(かゆみを取り去る) という意味で命名されたとの経緯があるそうです。
耳鼻科では?
耳鼻咽喉科で痒みを論じるとき、代表的な疾患は、外耳掻痒症です。
いわゆる、耳の中が痒い、という症状があります。
まず、外耳道の構造から見てみましょう。
外耳道
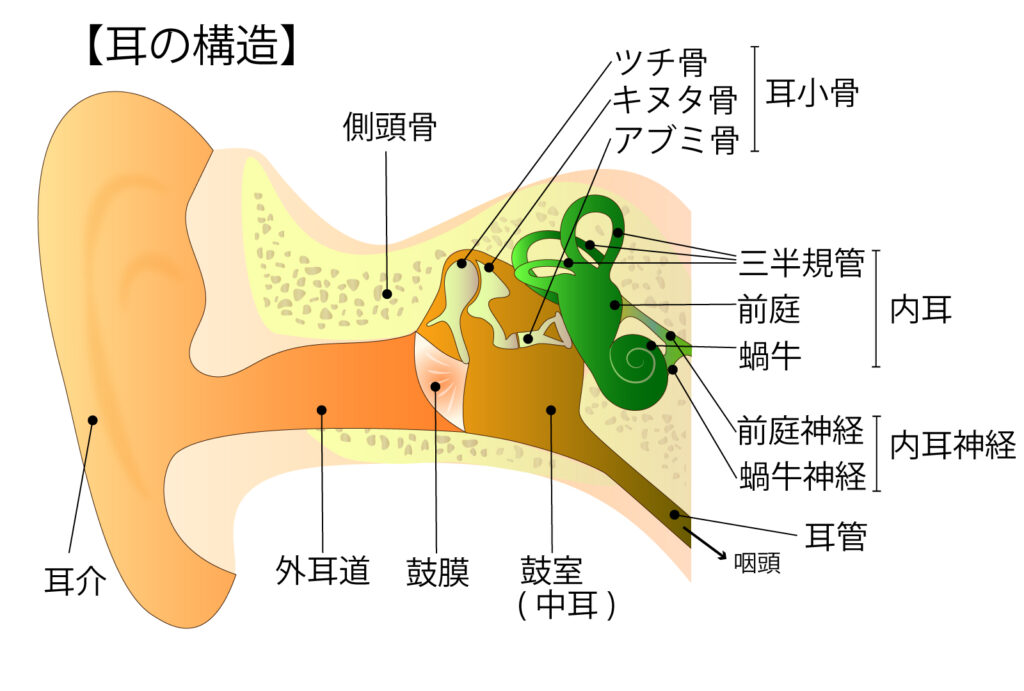
図10 耳の構造イラスト 外耳道
外耳掻痒症が起こるのは、外耳道です。
その理由は、外耳道が筒状の皮膚だからです。
外耳道は、外側1/3の軟骨部と内側2/3の骨部に分かれます。
軟骨部の皮膚はすこし厚めで、毛根や皮脂腺、耳垢腺(アポクリン汗腺)が存在します。したがって汗をかきやすく、皮脂腺から脂(あぶら)様物質も分泌されます。耳垢(じこう)は、おもにこの部分で作られます。 →耳垢(じこう)
骨部の皮膚は非常に薄く、皮脂腺、耳垢腺がありません。さらに硬い外耳道骨の上に薄く皮膚が張っているだけのため弾力性がなく、耳かきや綿棒などで擦ると、容易に傷つきます。
さらに骨部は、痛みに非常に敏感です。
外耳掻痒症とは?
外耳掻痒症は、ほとんどの場合、硬い耳かきや綿棒などで耳かきをして外耳道皮膚をつよく擦り、傷つけて、多くは外耳道炎または外耳道湿疹の状態で受診されます。
これは、耳の中が”痒い”ために、強い力で耳かきをすることが最も多い原因と思われていますが、何もないのに習慣性に頻繁に耳かきをしてしまい、外耳道皮膚に湿疹を起こすこともめずらしくありません。
痒くてたまらないから強く掻く、強く掻くことにより皮膚の湿疹が悪化してさらに痒みが強くなる、という悪循環に陥り、掻き傷(外傷)が拡がりつよい痛みが生じてきたり、外耳道皮膚に感染を起こしてくることもあります。
外耳道の知覚は非常に鋭敏にできています。
外耳道皮膚は三叉神経などによって支配されているため、とくに痛みには敏感になっています。 → 耳の痛み
外耳掻痒症の原因は?
外耳掻痒症は、いろいろなことが原因となって起こります。
習慣性の耳かき、綿棒の頻繁な使用、長時間の耳栓使用、補聴器の装用、などが原因になります。外耳道に直接的な刺激を加えて、外耳道のうすい皮膚を傷つけたりして症状が悪化します。
耳の疾患では、外耳道炎に掻痒感をともなう場合や、鼓膜炎による滲出液で鼓膜や外耳道が常に湿潤している状態のときは、外耳道皮膚に炎症が起こり、掻痒感があります。
また、鼓膜穿孔がある慢性中耳炎で耳漏がある場合などでも、外耳道から耳漏が出てくることや外耳道内に耳漏が貯まっていることの不快感から、頻回の綿棒清掃を繰り返して、外耳道皮膚の炎症や湿疹を起こしてしまい、掻痒感が起こります。
糖尿病や重症の免疫不全、全身的な皮膚疾患、皮膚のアトピー素因などがあると、外耳掻痒症は起こりやすくなります。
職業上の耳栓の使用や補聴器装用などは、1日のうち長時間に及ぶため気温の高い夏場など外耳道に汗をかきやすく、湿潤した環境になりやすいことに加え、補聴器の機械的な刺激によっても外耳道皮膚の湿疹を起こしやすい環境を作ります。
* 補聴器装用の場合は、補聴器を外している間の外耳道の乾燥に努めることと、耳鼻咽喉科での定期的な耳内清掃が重要になります。
このように、外耳掻痒症には、いくつかの原因となる疾患や病態が存在します。
しかしながら最大の原因は、耳かきや綿棒などでの「意図的な」耳掃除です。
とくに女性が、お風呂上がりなどに外耳道が湿潤した状態を耳垢で汚れていると思い込み、美容的な意識からもほぼ毎日、習慣的に頻繁な綿棒使用を継続することが多く、実際は清潔で何もない外耳道皮膚を擦りすぎて皮膚の炎症や湿疹を起こしてしまっている症例があとを断ちません。
また几帳面な男性で、髪や爪などの手入れと同時に、ほぼ毎日、習慣として硬い木製または金属製の耳かきを使用して、カリカリと外耳道奥の皮膚を掃除する方もいます。
このような耳掃除は、実際、何もないことも多いのですが、時として正常に近い外耳道皮膚を傷つけて皮膚炎や湿疹を起こしてしまい、湿疹によって生じた滲出液をまた汚れと勘違いしてさらに綿棒使用を続けて、結果として難治性の外耳掻痒症になってしまっていることも多々見受けられます。
また、外耳掻痒症とは直接の関係はありませんが、習慣的に毎日、木製や金属製の硬い耳かきで耳の奥を耳かきする方の中には、数年、数十年のうちに外耳道皮膚が剥離して骨が露出してしまい、それでも痛みを感じずに骨の上から耳かきをすることで、最終的に、がんが発生する症例もあります。
さらに、糖尿病や全身的な免疫不全の状態があると、外耳道湿疹が起こりやすく難治性になりやすい傾向があります。実際に外来診療中に難治性の外耳道湿疹から未治療の糖尿病が見つかる症例も経験します。
これらの良くない病態を自ら招いてしまう一つの大きな要因は、「耳の中を自分で観察できないこと」、と言えるかもしれません。
外耳掻痒症の痒みは?
臨床的な痒みの分類は、大きく2つに分けられることを先に書きました。
アトピー性皮膚炎などの皮膚症状をともなう痒みと、皮膚掻痒症と呼ばれる、皮膚症状をともなわない痒みです。
外耳掻痒症などによる、外耳道皮膚に起こっている痒みは、「皮膚疾患をともなう痒み」に分類されます。
しかしながら、通常の外耳掻痒症は、同じ皮膚炎や皮膚湿疹であっても、アトピー性皮膚炎などの特殊な疾患ではありません。
通常の外耳道湿疹 eczema は、皮膚炎 dermatitis と定義される疾患の1つになりますが、アトピー性皮膚炎はタイプ2炎症による免疫応答の1種に分類されています。
耳鼻咽喉科診療で頻繁に遭遇する、外耳掻痒症の代表的な疾患には、外耳炎、鼓膜炎、外耳道湿疹、外耳道真菌症、などがあります。
* 外耳道真菌症は、外耳道内に、Aspergillus niger や Candida albicans などの真菌塊が存在することによる耳感染症。外耳道に wet blotting paperと呼ばれる灰白色の厚い堆積物が見られることが多い。
これらの疾患は、すべて局所の炎症が原因になっている外耳掻痒症です。
ヒスタミンによる痒み
外耳掻痒症による、耳の痒みは基本的に、皮膚の痒みです。したがって、皮膚での起痒物質が痒みの原因を作ります。
綿棒などで外耳道皮膚をつよく引っ掻くと、表皮の剥離(はくり)が起こります。剥離が起こった皮膚は、皮膚のバリアー機能が低下して、皮膚の外部に存在する細菌やアレルゲン物質などの侵入を容易にします。また表皮で覆われていたため保持されていた水分が抜けて乾燥して、ドライスキンの状態になり、痒みを感じる末梢の知覚神経が伸びて過敏になります。

図11 表皮の剥離 角質層の脱落
表皮の角質層が脱落すると、皮下の水分が蒸発して失われ、外部からの異物や細菌の侵入を容易にします。すると、それを感知しやすいかのように、もとは真皮下にあった知覚神経がどんどん伸びて表皮の浅いところまで上がってくるのです。
したがって、軽微な刺激によっても痒みを感じやすく敏感になります。(図13)
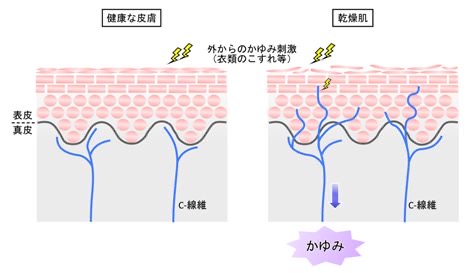
図13 痒みの知覚神経(C線維)
ドライスキンでは知覚神経が表皮下まで伸びてくる
https://www.juntendo.ac.jp/graduate/laboratory/labo/kankyo_igaku/kayumi/itch.html
① 表皮の剥奪による刺激は、肥満細胞を刺激して、肥満細胞からのヒスタミン遊離を起こします。
ヒスタミンは、血管拡張作用、血管透過性亢進作用などをもつ神経伝達物質です。そのため、ヒスタミンによって、表皮が剥奪した部分の皮膚の血管が拡張して血流が増えて充血を起こし、さらに血管透過性が亢進するために、血管外に血漿成分が浸み出します。
皮膚が充血と浮腫を起こした状態になり、いわゆる「炎症」が起こります。これが皮膚炎です。
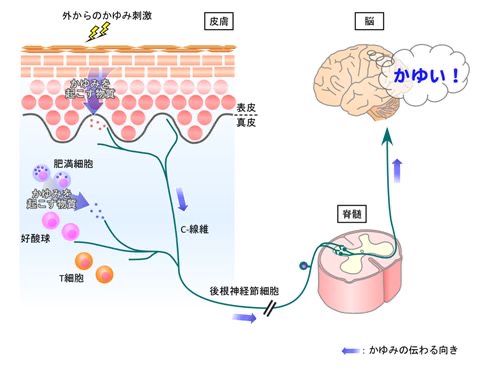
図12 皮膚での痒みのメカニズム
肥満細胞からヒスタミンが遊離され、痒みの知覚神経C線維を興奮させる
表皮の痒み物質(神経ペプチド)も同じく痒み刺激を起こす
https://www.juntendo.ac.jp/graduate/laboratory/labo/kankyo_igaku/kayumi/itch.html
② 遊離されたヒスタミンは、知覚神経終末のヒスタミン受容体を興奮させます。
表皮下の神経ペプチドは、それぞれ対応する受容体を興奮させます。
③ 知覚神経C線維の興奮は脊髄後角へ入力されます。
④ 脊髄後角では、 NpraやGRP受容体の興奮が起こり、痒みが伝達されます。(前述)
⑤ 脊髄後角の痒み刺激は、大脳皮質の頭頂葉内側部の楔前部(Precuneus)へ入力されて痒みを感じていることがわかっています。(写真1)
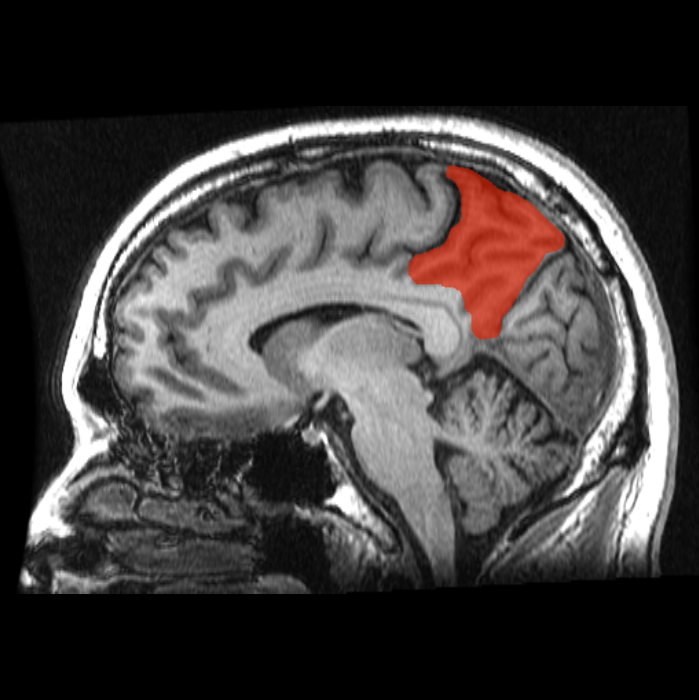
写真1 大脳皮質前頭葉 楔前部(Precuneus) MRI 画像 楔前部(Precuneus)🟥で示す
https://en.m.wikipedia.org/wiki/Precuneus
痒みの大脳皮質での受容については、今回は省略します。
外耳掻痒症の治療
外耳掻痒症は、外耳道皮膚の真皮に伸びている知覚神経C線維の終末にあるヒスタミン受容体が興奮することによる痒みです。
したがって、ヒスタミン受容体をブロックする働きのある抗ヒスタミン薬が効果があります。さらに当然ながら、皮膚の湿疹に対する局所治療が奏功します。(洗浄、軟膏塗布治療など)
もちろん、この頁で書かれているTRP受容体刺激のために、冷たいもので耳を冷やすことも、効果的であることがわかります。
アイスノンなどを耳介に当てて。
(耳内に冷水を入れたらだめです。)
外耳掻痒症の、痒みと痛み
外耳掻痒症による痒みは、外耳道の皮膚疾患をともなう痒みであり、先に書いたような皮膚疾患をともなわない中枢性の(全身的な)掻痒症ではありません。
したがって、先のκ受容体作動薬の適応になるような疾患ではなく、医学的に難治性と定義される掻痒症でもありません。
しかしながら、痒みはどのようにして起こり、どのように伝わるのか、そして、どのように抑制されるのか、に関しては皮膚の痒みも腎透析中の痒みもほとんど同一のメカニズムです。
また、“痒いとなぜ掻くのか?” という根本的な疑問に対する答えは全く同じです。
“外耳道皮膚が痒くて痒くてたまらないから、掻きむしることで皮膚の痛みを起こして、その痛みが脊髄後角で痒みをブロックする”
そういう仕組みになっているのです。
これは生体が、薬などなかった大昔から、痒みを止めるために体の中で工夫して編みだしてきた、合理的な生体反応の1つです。
人間も動物も、痒みを止めるために、痛みを感じるために掻いているのです。
あくまで、痒みからの一時的な逃避方法であって根本的な解決策ではありませんが。
人間の体は本当に不思議です。
だから、激しく耳かきをして良いのですよ、とはなりません。
最後に
痛み
痒み
オピオイド受容体
この3つについて書いてきました。
痛みと痒みは全く違う感覚であり、伝達経路も独立しています。
しかしながら、同一の受容体(κ受容体)を持っているために、唯一の接点であるκ受容体を介して、痒みのコントロールが可能であることが発見されました。
生体に存在する2つの違う感覚が、じつは非常に密接に関係していた事実は、たいへん興味深いことではないでしょうか。
少し以前までは、痒みは弱い痛みであると認識されていた時代がありました。今ではそれは間違いであることがわかっていますが、当時の医師、神経生理学者、神経科学者たちは、本能的に痒みと痛みの接点を察していたのかもしれません。
今回は、痒みについて基礎医学の知識を中心に、最後にすこしだけ耳の痒みについても理解していただく解説をしました。
痒みとは何か、痒みはどうして起こり、どのように伝わるのか、そしてどのように抑制されるのか、
などについてすこし詳しく説明したつもりです。
一部難解な部分があるかもしれませんが、痒みというありふれた感覚でありながら、意外に誰もよく知らない感覚に対して、少しでも理解して頂けたらと思います。
あなたの耳がかゆいとき
もし、あなたがご自分の耳が痒くなったら、今日読んだかゆみについて、少しだけ思い出してみてください。そうすれば、むやみに綿棒で耳をかきむしったりせずにすむかもしれません。
でも痒みは我慢できませんから、必ず、かかりつけの耳鼻咽喉科医に診てもらってください。
少しだけ掻いて、
冷たいもので耳を冷やして。

どうしても耳かきしてしまう…(イメージ)

綿棒(市販品)


金属製の耳かき